Liên kết cộng hoá trị: Khái niệm, đặc điểm và ứng dụng
Hãy cùng chúng tôi khám phá bản chất, đặc điểm và vai trò quan trọng của liên kết cộng hóa trị, từ đó mở rộng hiểu biết về thế giới vi mô đầy diệu kỳ!
Liên kết cộng hóa trị – “chìa khóa” mở ra cánh cửa thế giới hóa học vi mô! Nằm ở trung tâm cấu tạo phân tử, liên kết này đóng vai trò then chốt trong việc xác định tính chất vật lý, hóa học của vô số hợp chất mà ta gặp gỡ trong đời sống. Hãy cùng chúng tôi khám phá bản chất, đặc điểm và vai trò quan trọng của liên kết cộng hóa trị, từ đó mở rộng hiểu biết về thế giới vi mô đầy diệu kỳ!
Khái niệm liên kết cộng hoá trị
Định nghĩa:
Liên kết cộng hoá trị là liên kết hoá học được hình thành bằng việc dùng chung một hay nhiều cặp electron giữa các nguyên tử.
Đặc điểm:
- Hình thành do lực hút tĩnh điện giữa hạt nhân mang điện tích dương của nguyên tử này và các electron dùng chung của hai nguyên tử.
- Một cặp electron dùng chung tạo nên một liên kết cộng hoá trị.
- Số liên kết cộng hoá trị tối đa mà một nguyên tử có thể tạo được bằng số electron hóa trị của nó.
Ví dụ:
- Phân tử nước (H2O): Hình thành bởi 2 liên kết cộng hoá trị phân cực giữa 1 nguyên tử O và 2 nguyên tử H.
- Phân tử khí methane (CH4): Hình thành bởi 4 liên kết cộng hoá trị không cực giữa 1 nguyên tử C và 4 nguyên tử H.
Các đặc điểm của liên kết cộng hoá trị
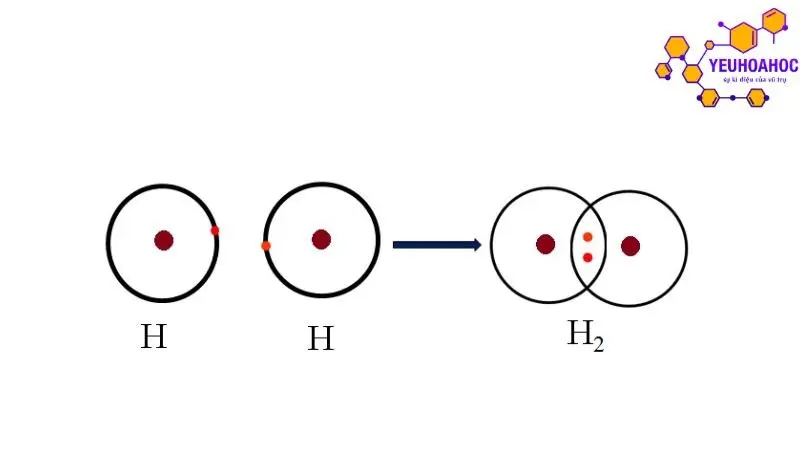
Sự chia sẻ electron
Cách thức:
Sự chia sẻ electron là quá trình hai hoặc nhiều nguyên tử đến gần nhau và chia sẻ một hoặc nhiều cặp electron để đạt được cấu hình electron bền vững (cấu hình octet). Khi chia sẻ electron, các nguyên tử sẽ hút lẫn nhau bởi lực hút tĩnh điện giữa hạt nhân mang điện tích dương và các electron dùng chung.
Ví dụ:
Hình thành phân tử hydrogen (H2):
- Hai nguyên tử hydrogen mỗi nguyên tử có 1 electron ở lớp ngoài cùng.
- Khi đến gần nhau, mỗi nguyên tử hydrogen chia sẻ 1 electron với nguyên tử hydrogen còn lại.
- Hai electron được chia sẻ tạo thành một cặp electron dùng chung, hình thành liên kết cộng hoá trị giữa hai nguyên tử hydrogen.
- Phân tử hydrogen (H2) được tạo thành với 1 liên kết cộng hoá trị.
Công thức electron: H . H Công thức cấu tạo: H – H
Hình thành phân tử nước (H2O):
- Một nguyên tử oxygen có 6 electron ở lớp ngoài cùng (cần thêm 2 electron để đạt cấu hình octet).
- Hai nguyên tử hydrogen mỗi nguyên tử có 1 electron ở lớp ngoài cùng (cần thêm 1 electron để đạt cấu hình octet).
- Khi đến gần nhau, nguyên tử oxygen chia sẻ 1 electron với mỗi nguyên tử hydrogen.
- Ba electron được chia sẻ tạo thành ba cặp electron dùng chung, hình thành hai liên kết cộng hoá trị giữa nguyên tử oxygen và hai nguyên tử hydrogen.
- Phân tử nước (H2O) được tạo thành với 2 liên kết cộng hoá trị.
Công thức electron: O . H . H Công thức cấu tạo: H – O – H
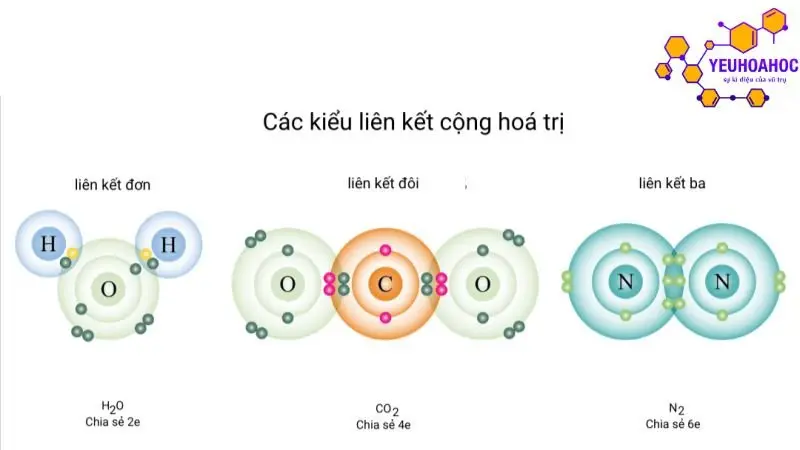
Liên kết đơn, đôi và ba
- Liên kết đơn:
Định nghĩa: Liên kết đơn là liên kết cộng hoá trị được hình thành bởi một cặp electron dùng chung giữa hai nguyên tử.
Đặc điểm:
-
- Là liên kết yếu nhất trong ba loại liên kết.
- Dễ dàng bị đứt ra trong các phản ứng hoá học.
- Độ dài liên kết dài nhất trong ba loại liên kết.
Ví dụ:
-
- Phân tử methane (CH4): Mỗi nguyên tử carbon trong phân tử methane liên kết với 4 nguyên tử hydrogen bằng 4 liên kết đơn.
- Phân tử chlorine (Cl2): Hai nguyên tử chlorine liên kết với nhau bằng 1 liên kết đơn.
- Liên kết đôi:
Định nghĩa: Liên kết đôi là liên kết cộng hoá trị được hình thành bởi hai cặp electron dùng chung giữa hai nguyên tử.
Đặc điểm:
-
- Mạnh hơn liên kết đơn nhưng yếu hơn liên kết ba.
- Khó bị đứt ra hơn liên kết đơn.
- Độ dài liên kết ngắn hơn liên kết đơn nhưng dài hơn liên kết ba.
Ví dụ:
-
- Phân tử ethene (C2H4): Hai nguyên tử carbon trong phân tử ethene liên kết với nhau bằng 1 liên kết đôi.
- Phân tử carbon dioxide (CO2): Nguyên tử carbon trong phân tử carbon dioxide liên kết với hai nguyên tử oxygen bằng hai liên kết đôi.
- Liên kết ba:
Định nghĩa: Liên kết ba là liên kết cộng hoá trị được hình thành bởi ba cặp electron dùng chung giữa hai nguyên tử.
Đặc điểm:
-
- Là dạng liên kết mạnh nhất trong ba loại liên kết.
- Rất khó bị đứt ra trong các phản ứng hoá học.
- Độ dài liên kết ngắn nhất trong ba loại liên kết.
Ví dụ:
-
- Phân tử ethyne (C2H2): Hai nguyên tử carbon trong phân tử ethyne liên kết với nhau bằng 1 liên kết ba.
- Phân tử nitrogen (N2): Hai nguyên tử nitrogen liên kết với nhau bằng 1 liên kết ba.
Bảng so sánh liên kết đơn, đôi và ba:
| Đặc điểm | Liên kết đơn | Liên kết đôi | Liên kết ba |
| Số cặp electron dùng chung | 1 | 2 | 3 |
| Độ bền | Yếu | Mạnh | Rất mạnh |
| Dễ bị đứt | Dễ | Khó | Rất khó |
| Độ dài liên kết | Dài | Ngắn | Nhất ngắn |
| Ví dụ | CH4, Cl2 | C2H4, CO2 | C2H2, N2 |
Độ dài và năng lượng liên kết cộng hoá trị
Độ dài liên kết cộng hoá trị:
Định nghĩa: Độ dài liên kết cộng hoá trị là khoảng cách trung bình giữa hai hạt nhân của các nguyên tử liên kết với nhau.
Cách xác định: Độ dài liên kết được xác định bằng phương pháp thực nghiệm như:
- Phân tích phổ giao thoa tia X.
- Phân tích phổ khuếch tán electron.
Mối quan hệ giữa độ dài và năng lượng liên kết:
Có mối quan hệ nghịch chiều:
- Độ dài liên kết càng ngắn, năng lượng liên kết càng lớn.
- Độ dài liên kết càng dài, năng lượng liên kết càng nhỏ.
Giải thích:
- Năng lượng liên kết là năng lượng cần thiết để tách rời một liên kết cộng hoá trị.
- Khi hai nguyên tử đến gần nhau hơn, lực hút tĩnh điện giữa hạt nhân và electron mạnh hơn, dẫn đến liên kết bền hơn và cần nhiều năng lượng hơn để phá vỡ.
- Ngược lại, khi hai nguyên tử xa nhau hơn, lực hút tĩnh điện yếu hơn, dẫn đến liên kết yếu hơn và cần ít năng lượng hơn để phá vỡ.
Ví dụ:
Phân tử ethyne (C2H2) có liên kết C-C ngắn hơn (120 pm) và năng lượng liên kết cao hơn (836 kJ/mol) so với phân tử ethene (C2H4) có liên kết C-C dài hơn (133 pm) và năng lượng liên kết thấp hơn (614 kJ/mol).
Các loại liên kết cộng hoá trị
Liên kết cộng hoá trị không cực
Định nghĩa:
Liên kết cộng hoá trị không cực là liên kết cộng hoá trị được hình thành giữa hai nguyên tử có độ âm điện xấp xỉ nhau. Trong liên kết này, cặp electron dùng chung được chia sẻ đồng đều giữa hai nguyên tử, dẫn đến điện tích âm được phân bố đều trên phân tử.
Đặc điểm:
- Không có cực điện trong phân tử.
- Lực hút tĩnh điện giữa hạt nhân và electron được phân bố đều.
- Phân tử có tính chất trung tính (không hút hay đẩy nam châm).
- Thường gặp ở các phân tử được tạo thành từ nguyên tử phi kim có độ âm điện xấp xỉ nhau.
Ví dụ:
- Phân tử hydrogen (H2): Hai nguyên tử hydrogen có độ âm điện xấp xỉ nhau (3.0), do đó cặp electron dùng chung được chia sẻ đồng đều, tạo thành liên kết cộng hoá trị không cực. Phân tử hydrogen không có cực điện, không hút hay đẩy nam châm.
Công thức electron: H . H Công thức cấu tạo: H – H - Phân tử oxygen (O2): Hai nguyên tử oxygen có độ âm điện xấp xỉ nhau (3.44), do đó cặp electron dùng chung được chia sẻ đồng đều, tạo thành liên kết cộng hoá trị không cực. Phân tử oxygen không có cực điện, không hút hay đẩy nam châm.
Công thức electron: O . O Công thức cấu tạo: O – O - Phân tử nitrogen (N2): Hai nguyên tử nitrogen có độ âm điện xấp xỉ nhau (3.04), do đó cặp electron dùng chung được chia sẻ đồng đều, tạo thành liên kết cộng hoá trị không cực. Phân tử nitrogen không có cực điện, không hút hay đẩy nam châm.
Công thức electron: N . N Công thức cấu tạo: N – N
Liên kết cộng hoá trị có cực
Định nghĩa:
Liên kết cộng hoá trị có cực là liên kết cộng hoá trị được hình thành giữa hai nguyên tử có độ âm điện khác nhau. Trong liên kết này, cặp electron dùng chung bị lệch về bên nguyên tử có độ âm điện lớn hơn, dẫn đến sự phân cực điện tích trên phân tử.
Đặc điểm:
- Có cực điện trong phân tử.
- Lực hút tĩnh điện giữa hạt nhân và electron được phân bố không đều.
- Phân tử có tính chất lưỡng cực (hút hay đẩy nam châm).
- Thường gặp ở các phân tử được tạo thành từ nguyên tử phi kim có độ âm điện khác nhau.
Ví dụ:
- Phân tử hydrogen chloride (HCl): Nguyên tử chlorine có độ âm điện cao hơn (3.16) so với nguyên tử hydrogen (2.2). Do đó, cặp electron dùng chung bị lệch về phía nguyên tử chlorine, tạo thành liên kết cộng hoá trị có cực. Phân tử hydrogen chloride có cực điện, đầu mang điện tích âm hướng về phía nguyên tử chlorine và đầu mang điện tích dương hướng về phía nguyên tử hydrogen.
Công thức electron: H . Cl Công thức cấu tạo: H – Cl (điện tích âm ở Cl, điện tích dương ở H) - Phân tử nước (H2O): Nguyên tử oxygen có độ âm điện cao hơn (3.44) so với nguyên tử hydrogen (2.2). Do đó, cặp electron dùng chung bị lệch về phía nguyên tử oxygen, tạo thành liên kết cộng hoá trị có cực. Phân tử nước có cực điện, đầu mang điện tích âm hướng về phía nguyên tử oxygen và hai đầu mang điện tích dương hướng về phía hai nguyên tử hydrogen.
Công thức electron: H . O . H Công thức cấu tạo: H – O – H (điện tích âm ở O, điện tích dương ở H) - Phân tử ammonia (NH3): Nguyên tử nitrogen có độ âm điện cao hơn (3.04) so với nguyên tử hydrogen (2.2). Do đó, cặp electron dùng chung bị lệch về phía nguyên tử nitrogen, tạo thành liên kết cộng hoá trị có cực. Phân tử ammonia có cực điện, đầu mang điện tích âm hướng về phía nguyên tử nitrogen và ba đầu mang điện tích dương hướng về phía ba nguyên tử hydrogen.
Công thức electron: H . N . H . H Công thức cấu tạo: H – N – H (điện tích âm ở N, điện tích dương ở H)
Sự khác biệt giữa liên kết cộng hoá trị có cực và không cực:
| Đặc điểm | Liên kết cộng hoá trị không cực | Liên kết cộng hoá trị có cực |
| Độ âm điện của hai nguyên tử | Xấp xỉ nhau | Khác nhau |
| Sự chia sẻ electron | Đồng đều | Thiên về phía nguyên tử có độ âm điện lớn hơn |
| Cực điện trong phân tử | Không có | Có |
| Tính chất | Trung tính | Lưỡng cực |
| Ví dụ | H2, O2, N2 | HCl, H2O, NH3 |
Các yếu tố ảnh hưởng đến liên kết cộng hoá trị
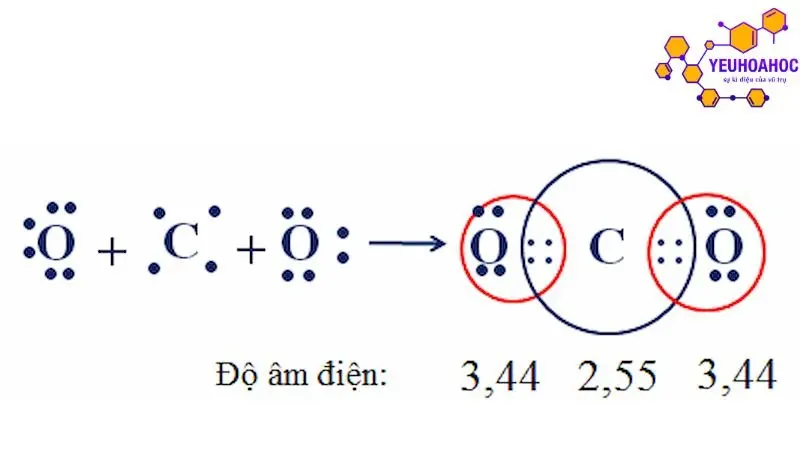
Độ âm điện
Độ âm điện là khả năng của một nguyên tử thu hút electron khi liên kết hóa học được hình thành. Nó được biểu thị bằng giá trị số trên thang Pauling, với giá trị cao nhất là 4,0 (fluorine) và thấp nhất là 0,8 (cesium).
Ảnh hưởng của độ âm điện đến tính chất liên kết:
Loại liên kết:
- Độ âm điện chênh lệch lớn: Hình thành liên kết ion. Ví dụ: NaCl (Natri clorua), MgO (Magie oxit).
- Độ âm điện chênh lệch nhỏ: Hình thành liên kết cộng hóa trị.
- Độ âm điện xấp xỉ nhau: Hình thành liên kết cộng hóa trị không cực. Ví dụ: H2 (Hydrogen), Cl2 (Clo), N2 (Nitơ).
- Độ âm điện khác nhau: Hình thành liên kết cộng hóa trị phân cực. Ví dụ: HCl (Hydrogen clorua), H2O (Nước), NH3 (Amoniac).
Độ bền liên kết:
- Độ âm điện chênh lệch lớn: Liên kết ion mạnh hơn liên kết cộng hóa trị.
- Độ âm điện chênh lệch nhỏ: Liên kết cộng hóa trị không cực mạnh hơn liên kết cộng hóa trị phân cực.
Độ dài liên kết:
- Độ âm điện chênh lệch lớn: Liên kết ion có độ dài ngắn hơn liên kết cộng hóa trị.
- Độ âm điện chênh lệch nhỏ: Liên kết cộng hóa trị không cực có độ dài ngắn hơn liên kết cộng hóa trị phân cực.
Ví dụ:
NaCl (Natri clorua):
- Natri (Na) có độ âm điện 0,93, Clo (Cl) có độ âm điện 3,16.
- Độ âm điện chênh lệch lớn (3,16 – 0,93 = 2,23) nên hình thành liên kết ion.
- Liên kết ion NaCl mạnh, bền và có độ dài ngắn.
H2O (Nước):
- Hiđrogen (H) có độ âm điện 2,2, Oxi (O) có độ âm điện 3,44.
- Độ âm điện chênh lệch nhỏ (3,44 – 2,2 = 1,24) nên hình thành liên kết cộng hóa trị phân cực.
- Phân tử H2O có cực điện, đầu mang điện tích âm hướng về phía nguyên tử O và hai đầu mang điện tích dương hướng về phía hai nguyên tử H.
- Liên kết cộng hóa trị phân cực trong H2O yếu hơn liên kết ion trong NaCl, có độ dài dài hơn và dễ bị đứt ra.
NH3 (Amoniac):
- Nitơ (N) có độ âm điện 3,04, Hiđrogen (H) có độ âm điện 2,2.
- Độ âm điện chênh lệch nhỏ (3,04 – 2,2 = 0,84) nên hình thành liên kết cộng hóa trị phân cực.
- Phân tử NH3 có cực điện, đầu mang điện tích âm hướng về phía nguyên tử N và ba đầu mang điện tích dương hướng về phía ba nguyên tử H.
- Liên kết cộng hóa trị phân cực trong NH3 yếu hơn liên kết ion trong NaCl, có độ dài dài hơn và dễ bị đứt ra.
Sự lai hóa orbital
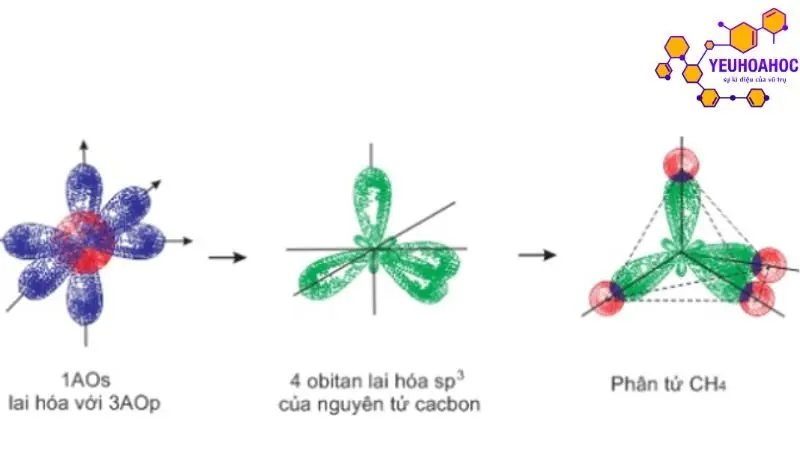
Khái niệm:
Sự lai hóa orbital là hiện tượng trộn lẫn các orbital nguyên tử (AO) có năng lượng tương đương nhau trong cùng một phân lớp để tạo thành những orbital lai hóa mới (orbital lai) có năng lượng và hình dạng giống nhau. Orbital lai có hình dạng và định hướng không gian phù hợp hơn cho sự hình thành liên kết hóa học.
Vai trò:
- Giải thích cấu tạo và tính chất của các hợp chất: Sự lai hóa orbital giúp giải thích cấu tạo hình học, tính chất vật lý và hóa học của các phân tử, đặc biệt là các phân tử cộng hóa trị.
- Dự đoán loại liên kết và số lượng liên kết: Dựa vào sự lai hóa orbital, ta có thể dự đoán loại liên kết (cộng hóa trị, ion) và số lượng liên kết tối đa mà một nguyên tử có thể tạo được.
- Giải thích sự hình thành các hợp chất phức: Sự lai hóa orbital đóng vai trò quan trọng trong việc giải thích sự hình thành các hợp chất phức, với các orbital lai tham gia vào sự hình thành liên kết sigma (σ) và liên kết pi (π).
Ví dụ minh họa:
Methane (CH4):
- Carbon (C) có 1 orbital s và 3 orbital p ở phân lớp 2.
- Sự lai hóa sp3 trộn lẫn 1 orbital s và 3 orbital p, tạo thành 4 orbital lai sp3 có hình dạng tứ diện đều.
- Bốn orbital lai sp3 của carbon liên kết với 4 orbital s của 4 nguyên tử hydrogen, tạo thành phân tử methane (CH4) có cấu tạo hình tứ diện đều.
- Công thức electron: C . H . H . H Công thức cấu tạo: H – C – H (điện tích âm ở N, điện tích dương ở H)
Ammonia (NH3):
- Nitơ (N) có 1 orbital s và 3 orbital p ở phân lớp 2.
- Sự lai hóa sp3 trộn lẫn 1 orbital s và 3 orbital p, tạo thành 4 orbital lai sp3 có hình dạng tứ diện đều.
- Ba orbital lai sp3 của nitơ liên kết với 3 orbital s của 3 nguyên tử hydrogen, tạo thành phân tử ammonia (NH3) có cấu tạo hình tứ diện đều. Tuy nhiên, do 1 cặp electron dùng chung của nitrogen không tham gia liên kết, nên phân tử ammonia có cấu tạo hình chóp tam giác đều với 1 cặp electron dùng chung ở đỉnh chóp.
- Công thức electron: N . H . H . H Công thức cấu tạo: H – N – H (điện tích âm ở N, điện tích dương ở H)
Water (H2O):
- Oxygen (O) có 1 orbital s và 3 orbital p ở phân lớp 2.
- Sự lai hóa sp3 trộn lẫn 1 orbital s và 3 orbital p, tạo thành 4 orbital lai sp3 có hình dạng tứ diện đều.
- Hai orbital lai sp3 của oxygen liên kết với 2 orbital s của 2 nguyên tử hydrogen, tạo thành phân tử water (H2O) có cấu tạo hình chữ V. Tuy nhiên, do 2 cặp electron dùng chung của oxygen không tham gia liên kết, nên phân tử water có cấu tạo hình chữ V cong với 2 cặp electron dùng chung ở hai đỉnh.
- Công thức electron: O . H . H Công thức cấu tạo: H – O – H (điện tích âm ở O, điện tích dương ở H)
Ứng dụng của liên kết cộng hóa trị
Trong hóa học:
- Giải thích cấu tạo và tính chất của các hợp chất: Liên kết cộng hóa trị giúp giải thích cấu tạo hình học, tính chất vật lý và hóa học của các phân tử, đặc biệt là các phân tử phi kim.
- Dự đoán loại liên kết và số lượng liên kết: Dựa vào sự lai hóa orbital và độ âm điện, ta có thể dự đoán loại liên kết (cộng hóa trị, ion) và số lượng liên kết tối đa mà một nguyên tử có thể tạo được.
- Giải thích sự hình thành các hợp chất phức: Sự lai hóa orbital đóng vai trò quan trọng trong việc giải thích sự hình thành các hợp chất phức, với các orbital lai tham gia vào sự hình thành liên kết sigma (σ) và liên kết pi (π).
Trong sinh học:
- Hình thành các phân tử sinh học: Các phân tử sinh học quan trọng như DNA, RNA, protein, carbohydrate, lipid đều được cấu tạo từ các liên kết cộng hóa trị.
- Quá trình trao đổi chất: Liên kết cộng hóa trị đóng vai trò quan trọng trong các phản ứng hóa học xảy ra trong cơ thể sinh vật, giúp duy trì sự sống.
- Lưu trữ và truyền thông tin di truyền: DNA được cấu tạo từ các liên kết cộng hóa trị giữa các nucleotide, giúp lưu trữ thông tin di truyền vàchuyển giao thông tin từ thế hệ này sang thế hệ khác.
Trong vật liệu:
- Polymer: Các polymer (nhựa) được cấu tạo từ các chuỗi dài các phân tử được liên kết với nhau bằng liên kết cộng hóa trị. Polymer có nhiều ứng dụng trong đời sống như sản xuất đồ nhựa, cao su, sợi tổng hợp, v.v.
- Tinh thể: Nhiều tinh thể phi kim (như kim cương, silicon) được cấu tạo từ các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. Tinh thể có nhiều ứng dụng trong công nghiệp điện tử, quang học, v.v.
Trong công nghệ:
- Sản xuất bán dẫn: Bán dẫn được cấu tạo từ các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị, đóng vai trò quan trọng trong sản xuất các thiết bị điện tử như transistor, chip, v.v.
- Pin nhiên liệu: Pin nhiên liệu sử dụng phản ứng hóa học giữa nhiên liệu (như hydro, methane) và oxy để tạo ra điện năng. Liên kết cộng hóa trị đóng vai trò quan trọng trong quá trình này.
- Catalytic converter: Catalytic converter sử dụng các chất xúc tác để chuyển đổi khí thải độc hại từ xe ô tô thành khí cacbonic và nước. Liên kết cộng hóa trị đóng vai trò quan trọng trong quá trình này.
Liên kết cộng hóa trị là một liên kết hóa học quan trọng, đóng vai trò thiết yếu trong cấu tạo và tính chất của nhiều hợp chất. Việc hiểu rõ về bản chất, đặc điểm và ứng dụng của liên kết cộng hóa trị giúp chúng ta giải thích nhiều hiện tượng hóa học, đồng thời có ứng dụng trong nhiều lĩnh vực sản xuất và đời sống.







