Liên kết ion: Khái niệm, tính chất và ứng dụng
Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn đi sâu vào thế giới của liên kết ion, khám phá bản chất, đặc điểm, ví dụ và ứng dụng của chúng trong đời sống.
Hóa học ẩn chứa vô vàn điều kỳ diệu, và một trong số đó chính là “liên kết ion” – lực hút tĩnh điện mạnh mẽ giữa các ion trái dấu, đóng vai trò then chốt trong cấu tạo và tính chất của hợp chất ion. Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn đi sâu vào thế giới của liên kết ion, khám phá bản chất, đặc điểm, ví dụ và ứng dụng của chúng trong đời sống.
Khái niệm liên kết ion
Liên kết ion, còn được gọi là liên kết điện tích, là một dạng liên kết hóa học phát sinh do lực hút tĩnh điện giữa các ion có điện tích đối lập. Nói cách khác, liên kết ion là sự kết hợp giữa các nguyên tử kim loại điển hình nhường electron để tạo thành cation và các nguyên tử phi kim điển hình nhận electron để tạo thành anion. Các ion trái dấu hút nhau tạo thành hợp chất ion.
Điều kiện hình thành liên kết ion:
- Sự khác biệt về tính chất hóa học: Kim loại điển hình có xu hướng nhường electron để đạt cấu hình electron giống khí hiếm gần nhất, tạo thành cation mang điện tích dương. Phi kim điển hình có xu hướng nhận electron để đạt cấu hình electron giống khí hiếm gần nhất, tạo thành anion mang điện tích âm.
- Hiệu số độ âm điện: Hiệu số độ âm điện (∆EN) giữa hai nguyên tử càng lớn, khả năng hình thành liên kết ion càng cao. Theo quy ước, nếu ∆EN ≥ 1,7 thì được coi là liên kết ion (trừ một số trường hợp đặc biệt).
Ví dụ:
- Na (kim loại) nhường 1 electron để tạo thành Na⁺ (cation) và Cl (phi kim) nhận 1 electron để tạo thành Cl⁻ (anion). Hai ion trái dấu hút nhau bằng lực tĩnh điện, tạo thành hợp chất NaCl (muối ăn).
Bản chất của liên kết ion
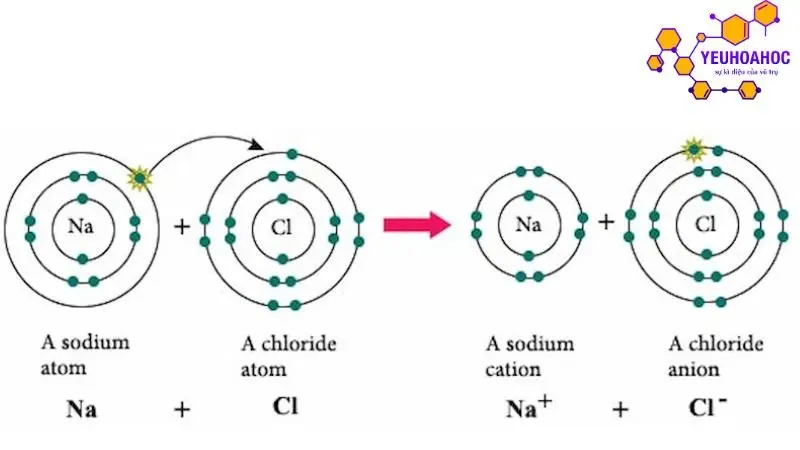
Quá trình hình thành liên kết ion
Nguyên tử kim loại nhường electron, tạo thành cation:
- Nguyên tử kim loại điển hình có cấu hình electron lớp ngoài cùng s hoặc s² dễ mất electron để đạt cấu hình electron giống khí hiếm gần nhất, tạo thành cation mang điện tích dương.
- Ví dụ: Na (Z = 11) có cấu hình electron 1s²2s²2p⁶. Khi mất 1 electron, Na tạo thành cation Na⁺ với cấu hình electron 1s²2s²2p⁵, giống cấu hình electron của khí hiếm neon (Ne).
Nguyên tử phi kim nhận electron, tạo thành anion:
- Nguyên tử phi kim điển hình có cấu hình electron lớp ngoài cùng thiếu 1 hoặc 2 electron so với cấu hình electron của khí hiếm gần nhất. Do đó, chúng có xu hướng nhận electron để đạt cấu hình electron giống khí hiếm.
- Ví dụ: Cl (Z = 17) có cấu hình electron 1s²2s²2p⁶3s²3p⁵. Khi nhận 1 electron, Cl tạo thành anion Cl⁻ với cấu hình electron 1s²2s²2p⁶3s²3p⁶, giống cấu hình electron của khí hiếm argon (Ar).
Các ion trái dấu hút nhau bằng lực tĩnh điện, hình thành liên kết ion:
- Khi nguyên tử kim loại nhường electron cho nguyên tử phi kim, cả hai nguyên tử đều mang điện tích trái dấu.
- Cation mang điện tích dương (+) sẽ hút anion mang điện tích âm (-) bằng lực tĩnh điện.
- Lực hút tĩnh điện này đủ mạnh để giữ cho các ion liên kết với nhau, hình thành liên kết ion.
Sơ đồ minh họa
Kim loại (Na) -> Nhường 1e⁻ -> Cation Na⁺ (1s²2s²2p⁵)
↑
↓
Phi kim (Cl) <- Nhận 1e⁻ <- Anion Cl⁻ (1s²2s²2p⁶3s²3p⁶)
Ví dụ:
- Hình thành liên kết ion trong NaCl:
Na (1s²2s²2p⁶) -> Nhường 1e⁻ -> Na⁺ (1s²2s²2p⁵)
↑
↓
Cl (1s²2s²2p⁶3s²3p⁵) <- Nhận 1e⁻ <- Cl⁻ (1s²2s²2p⁶3s²3p⁶)
Na⁺ + Cl⁻ → NaCl
Ví dụ về hợp chất ion
Natri clorua (NaCl):
- Công thức hóa học: NaCl
- Tên gọi: Muối ăn
- Ứng dụng:
- Là gia vị phổ biến trong đời sống.
- Dùng để bảo quản thực phẩm.
- Sử dụng trong sản xuất xà phòng, chất tẩy rửa.
- Dùng trong y tế để điều trị mất nước, điện giải.
Kali clorua (KCl):
- Công thức hóa học: KCl
- Tên gọi: Muối kali
- Ứng dụng:
- Dùng làm phân bón cho cây trồng.
- Sản xuất thuốc nổ.
- Sử dụng trong y tế để điều trị rối loạn nhịp tim, hạ kali máu.
Canxi cacbonat (CaCO3):
- Công thức hóa học: CaCO3
- Tên gọi: Đá vôi, đá hoa cương
- Ứng dụng:
- Dùng làm nguyên liệu sản xuất xi măng.
- Sản xuất kính, thủy tinh.
- Dùng trong ngành khai thác khoáng sản.
- Dùng trong y tế để trung hòa axit dạ dày.
Magie oxit (MgO):
- Công thức hóa học: MgO
- Tên gọi: Magnesia
- Ứng dụng:
- Dùng làm phụ gia thực phẩm.
- Sản xuất thuốc nhuận tràng.
- Dùng để xử lý nước thải.
- Chế tạo vật liệu chịu nhiệt.
Canxi sunfat (CaSO4):
- Công thức hóa học: CaSO4
- Tên gọi: Thạch cao
- Ứng dụng:
- Dùng trong xây dựng, sản xuất thạch cao.
- Sản xuất xi măng.
- Dùng trong y tế để bó bột xương gãy.
- Dùng trong ngành giấy.
Natri hydroxit (NaOH):
- Công thức hóa học: NaOH
- Tên gọi: Xút ăn da
- Ứng dụng:
- Dùng trong công nghiệp hóa chất.
- Sản xuất xà phòng, chất tẩy rửa.
- Dùng để thông cống, nghẽn.
- Dùng trong y tế để rửa vết thương, trung hòa axit.
Natri cacbonat (Na2CO3):
- Công thức hóa học: Na2CO3
- Tên gọi: Soda
- Ứng dụng:
- Dùng trong công nghiệp thực phẩm.
- Sản xuất thủy tinh.
- Dùng để tẩy rửa, làm mềm nước.
- Dùng trong y tế để điều trị chứng ợ nóng, khó tiêu.
Tính chất của hợp chất ion
Tính chất vật lý
- Trạng thái rắn ở nhiệt độ thường: Hầu hết các hợp chất ion đều ở trạng thái rắn ở nhiệt độ thường. Ví dụ: NaCl (muối ăn), CaCO3 (đá vôi), MgO (magie oxit).
- Có tinh thể: Các hợp chất ion có cấu trúc tinh thể dạng mạng lưới ba chiều, được hình thành bởi các ion mang điện tích trái dấu xếp xen kẽ nhau.
- Dễ nóng chảy và dễ bay hơi: Do lực hút tĩnh điện giữa các ion giảm dần khi nhiệt độ tăng, các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp so với các hợp chất cộng hóa trị có cùng phân tử khối. Ví dụ: NaCl có nhiệt độ nóng chảy là 801°C, trong khi sucrose (C12H22O11) có nhiệt độ nóng chảy là 160°C.
- Dẫn điện tốt: Khi tan trong nước hoặc ở trạng thái nóng chảy, các hợp chất ion phân li thành các ion có thể di chuyển tự do, do đó dung dịch của chúng dẫn điện tốt. Ví dụ: dung dịch NaCl dẫn điện tốt hơn dung dịch glucose (C6H12O6).
Tính chất hóa học
- Phản ứng hóa học xảy ra chủ yếu là phản ứng trao đổi ion: Trong các phản ứng hóa học, các hợp chất ion thường tham gia bằng cách trao đổi các ion với nhau. Ví dụ:
- Phản ứng thủy phân: Một số hợp chất ion có thể tác dụng với nước tạo ra axit hoặc bazơ và muối. Ví dụ:
Ngoài ra, hợp chất ion còn có một số tính chất khác như:
- Khó tan trong dung môi không phân cực: Các hợp chất ion có lực hút tĩnh điện mạnh giữa các ion, do đó khó tan trong các dung môi không phân cực như benzen, ete.
- Có tính khử mạnh: Một số hợp chất ion kim loại có thể tác dụng với phi kim mạnh hơn để giải phóng kim loại. Ví dụ:
Ứng dụng của hợp chất ion
Công nghiệp:
Sản xuất hóa chất:Hợp chất ion được sử dụng để sản xuất nhiều loại hóa chất quan trọng như axit, bazơ, muối, v.v. Ví dụ: NaCl (muối ăn) được dùng để sản xuất xút ăn da (NaOH), Clo (Cl2),…
Kim loại:Một số hợp chất ion kim loại được điện phân để thu hồi kim loại. Ví dụ: Al2O3 (nhôm oxit) được điện phân nóng chảy để thu hồi nhôm (Al).
Vật liệu xây dựng: Hợp chất ion được sử dụng để sản xuất xi măng, gạch, vôi, v.v. Ví dụ: CaCO3 (đá vôi) được sử dụng để sản xuất xi măng.
Nông nghiệp:
Phân bón:Một số hợp chất ion được sử dụng làm phân bón để cung cấp dinh dưỡng cho cây trồng. Ví dụ: KCl (muối kali) cung cấp kali cho cây trồng, giúp tăng cường sức đề kháng và cải thiện chất lượng sản phẩm.
Thuốc trừ sâu:Một số hợp chất ion được sử dụng làm thuốc trừ sâu để tiêu diệt sâu bệnh hại cây trồng. Ví dụ: CuSO4 (đồng sunfat) được sử dụng để trừ nấm bệnh trên cây trồng.
Y học:
Thuốc chữa bệnh: Một số hợp chất ion được sử dụng để sản xuất thuốc chữa bệnh. Ví dụ: NaCl (muối ăn) được sử dụng để pha dung dịch tiêm truyền, NaHCO3 (natri bicarbona) được sử dụng để trung hòa axit dạ dày.
Dung dịch sát khuẩn: Một số hợp chất ion được sử dụng để sản xuất dung dịch sát khuẩn. Ví dụ: NaClO (natri hypoclorit) được sử dụng để khử trùng dụng cụ y tế, nước sinh hoạt.
Đời sống:
Muối ăn (NaCl):Muối ăn là gia vị không thể thiếu trong đời sống, được sử dụng để nêm nếm thức ăn, bảo quản thực phẩm.
Gia vị:Một số hợp chất ion được sử dụng làm gia vị để tăng thêm hương vị cho món ăn. Ví dụ: KCl (muối kali) được sử dụng để làm muối tiêu, bột ngọt (MSG) có chứa ion natri (Na⁺) và glutamat (C5H8NO4⁻).
Tinh thể mạng ion
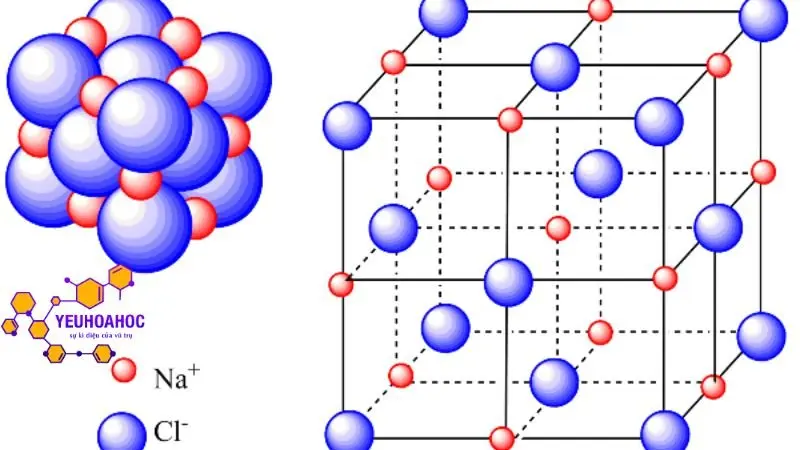
Tinh thể mạng ion là mạng tinh thể được hình thành bởi các ion mang điện tích trái dấu xếp xen kẽ nhau theo trật tự nhất định. Các ion trong mạng tinh thể mạng ion được liên kết với nhau bởi lực hút tĩnh điện mạnh.
Đặc điểm của tinh thể mạng ion:
- Có cấu trúc ba chiều: Các ion trong mạng tinh thể mạng ion được xếp theo trật tự nhất định, tạo thành cấu trúc ba chiều.
- Có độ rắn chắc cao: Do lực hút tĩnh điện mạnh giữa các ion, mạng tinh thể mạng ion có độ rắn chắc cao.
- Có nhiệt độ nóng chảy và nhiệt độ sôi cao: Nhiệt độ nóng chảy và nhiệt độ sôi của các hợp chất ion thường cao do cần cung cấp nhiều năng lượng để phá vỡ lực hút tĩnh điện giữa các ion.
- Dẫn điện tốt: Khi tan trong nước hoặc ở trạng thái nóng chảy, các hợp chất ion phân li thành các ion có thể di chuyển tự do, do đó dung dịch của chúng dẫn điện tốt.
- Tan tốt trong nước: Các hợp chất ion có mạng tinh thể mạng ion thường tan tốt trong nước do nước có khả năng phân cực các ion.
Ví dụ về tinh thể mạng ion:
NaCl (muối ăn)
CaCO3 (đá vôi)
MgO (magie oxit)
Cấu trúc của một số loại tinh thể mạng ion thường gặp:
- Cấu trúc lập phương: Cấu trúc lập phương là loại cấu trúc tinh thể mạng ion phổ biến nhất. Trong cấu trúc này, các ion được xếp thành các mạng lập phương, mỗi ion ở vị trí tâm của một khối lập phương nhỏ. Ví dụ: NaCl, CaCl2.
- Cấu trúc lục phương: Cấu trúc lục phương cũng là loại cấu trúc tinh thể mạng ion phổ biến. Trong cấu trúc này, các ion được xếp thành các mạng lục phương, mỗi ion ở vị trí tâm của một khối lục phương nhỏ. Ví dụ: MgO, ZnO.
- Cấu trúc lập phương tâm mặt: Cấu trúc lập phương tâm mặt là loại cấu trúc tinh thể mạng ion ít phổ biến hơn. Trong cấu trúc này, có một ion ở vị trí tâm của một khối lập phương lớn và 6 ion khác ở vị trí tâm mặt của khối lập phương lớn. Ví dụ: CsCl, KBr.
Bài tập áp dụng
Bài tập: Tính toán lực hút Coulomb giữa các ion trong tinh thể NaCl
Đề bài: Xét một tinh thể natri clorua (NaCl), một hợp chất tạo thành từ liên kết ion giữa các ion Na\(^+\) và Cl\(^-\). Biết khoảng cách giữa hai ion trong tinh thể là 0.282 nm. Tính lực hút Coulomb giữa hai ion này.
Thông tin cần nhớ:
\[\text{Hằng số Coulomb } k = 8.9875 \times 10^9 \, \text{N m}^2/\text{C}^2\]
\[\text{Điện tích của electron } e = 1.602 \times 10^{-19} \, \text{Coulombs}\]
Giải:
Bước 1: Chuyển đổi khoảng cách từ nm sang mét:
\[ r = 0.282 \, \text{nm} = 0.282 \times 10^{-9} \, \text{m} \]
Bước 2: Sử dụng công thức lực Coulomb để tính toán lực hút giữa hai ion:
\[ F = \frac{k \cdot q_1 \cdot q_2}{r^2} \]
trong đó \(q_1 = +e\) và \(q_2 = -e\), và \(r\) là khoảng cách giữa chúng.
Bước 3: Thay số vào công thức:
\[ F = \frac{8.9875 \times 10^9 \cdot (1.602 \times 10^{-19}) \cdot (-1.602 \times 10^{-19})}{(0.282 \times 10^{-9})^2} \, \text{N} \]
Bước 4: Tính toán:
\[ F = \frac{8.9875 \times 10^9 \cdot 2.5664 \times 10^{-38}}{7.9524 \times 10^{-20}} \, \text{N} \]
\[ F = 8.9875 \times 10^9 \times 3.227 \times 10^{-19} \, \text{N} \]
\[ F = 2.901 \times 10^{-9} \, \text{N} \]
Kết luận:
Lực hút Coulomb giữa hai ion Na\(^+\) và Cl\(^-\) trong tinh thể natri clorua là khoảng \(2.901 \times 10^{-9} \, \text{N}\).
Liên kết ion – tuy chỉ là một khái niệm nhỏ bé trong Hóa học, nhưng lại mang tầm ảnh hưởng to lớn, góp phần tạo nên sự đa dạng của thế giới vật chất và đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống. Hiểu rõ về liên kết ion sẽ giúp bạn mở ra cánh cửa khám phá những điều kỳ diệu của Hóa học và ứng dụng chúng một cách hiệu quả.







